Nature: 低血糖饮食通过改变脂质代谢抑制肿瘤生长
2021年10月,麻省理工学院等单位的相关研究人员在《Nature》(IF: 50)上发表了题为“Low glycaemic diets alter lipid metabolism to influence tumour growth”的研究论文,揭示了低血糖饮食对肿瘤生长的抑制作用及其相关机制。
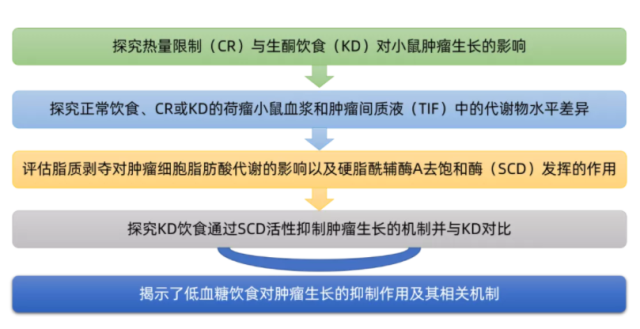
饮食干预可以改变在肿瘤微环境的代谢物的水平,然后这可能会影响癌症细胞代谢以改变肿瘤的生长。低血糖饮食通常被认为是通过降低血糖和胰岛素水平来抑制肿瘤生长的,但其他营养素的变化是否也有作用尚不清楚。研究人员首先探讨了热量限制(CR)与生酮饮食(KD)对小鼠肿瘤生长的影响,发现在涉及不同组织的两种癌症模型中,肿瘤生长不受KD影响,只有CR抑制肿瘤生长。两种饮食都会导致血糖水平类似的降低。此外,只有KD显著降低空腹血浆胰岛素水平,尽管CR导致胰岛素水平下降。因此,CR对肿瘤生长的影响可能不能完全用血糖和胰岛素的降低来解释。接着,研究人员测量了喂食对照饮食、CR或KD的荷瘤小鼠血浆和肿瘤间质液(TIF)中的代谢物水平。值得注意的是,尽管降低了血糖水平,KD并没有降低TIF血糖水平,而CR将TIF血糖从~1.6mM降低至~0.8mM。CR对TIF葡萄糖的影响可能在一定程度上有助于抑制肿瘤生长,但是,因为将葡萄糖降低到0.8 mM对细胞增殖的影响最小,其他营养素可用性的变化也可能导致CR的影响。
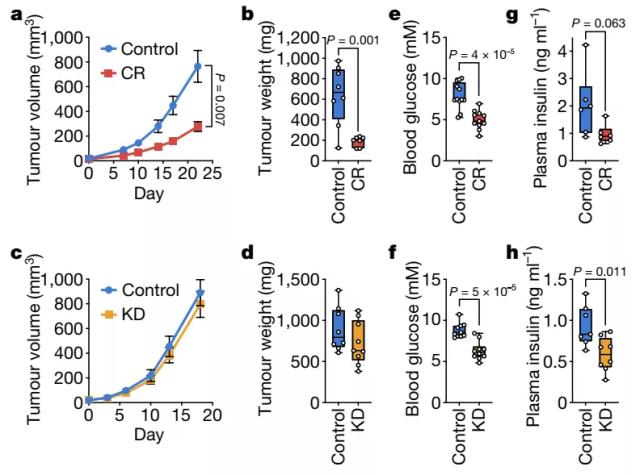
CR,而不是KD,会损害胰腺导管腺癌同种异体移植肿瘤的生长
CR和KD对许多代谢物的水平影响较小。最值得注意的是,KD更有效地提高了“酮”β-羟基丁酸酯(β-OHB)的水平。酮水平的增加可能有助于解释为什么KD不能抑制该模型中的肿瘤生长。此外,研究人员发现CR和KD对脂肪酸水平的影响存在显著差异。尽管KD增加了血浆和TIF中的许多脂肪酸,但CR几乎降低了所有脂肪酸的水平。因此,脂质和脂肪酸的肿瘤利用率降低是CR特有的,环境脂质限制可能有助于CR抑制肿瘤生长。为了评估脂质剥夺如何影响细胞脂肪酸代谢,研究人员将细胞培养在只含有微量脂肪酸的去脂质培养基中。来源于各种组织的癌细胞仍然可以在去脂培养基中增殖,尽管速度较慢。脂肪损耗降低了多不饱和脂肪酸(PUFA)的细胞水平,因为这些必需脂肪酸不能由哺乳动物细胞合成,必须从环境中获得。相反,饱和脂肪酸(SFA)和单不饱和脂肪酸(MUFA)的水平相对保持,与促进SREBP1转录因子激活和从头脂肪酸合成的外源性脂质限制一致。
有趣的是,在脂质耗尽条件下培养的细胞中,16:1(n-7)MUFA水平显著增加。硬脂酰辅酶A去饱和酶(SCD)分别负责从16:0和18:0 SFA合成16:1(n-7)和18:1(n-9)MUFA。16:1(n-7)/16:0和18:1(n-9)/18:0的比例,作为SCD活性的替代物,在脂饥饿细胞中显著增加,而SCD抑制剂A939572则降低。一致地,脂质饥饿的细胞通过SCD表现出增加的通量,并且SCD抑制仅在所有受试细胞的脂质耗尽培养基中损害增殖,并诱导细胞死亡。因此,当外源性脂质含量较少时,这些癌细胞需要上调SCD活性。进一步探究SCD抑制对细胞的毒性作用发现,尽管SFA积累在SCD抑制后诱导细胞死亡中具有重要意义,但仍需要通过SCD活性获取不饱和脂肪酸以实现最佳的脂质饥饿癌细胞增殖。在缺乏脂质的环境中,SCD活性对癌细胞至关重要。当SCD抑制扰乱不饱和脂肪酸和饱和脂肪酸之间的平衡时,细胞增殖受损,当SFA积累时,细胞死亡。研究人员进一步发现,而 CR 也会损害肿瘤 SCD 活性,导致不饱和脂肪酸和饱和脂肪酸之间的不平衡,从而减缓肿瘤的发展生长。相比之下,虽然 KD 也会损害肿瘤 SCD 活性,KD 驱动的脂质可用性增加维持了肿瘤中不饱和脂肪酸与饱和脂肪酸的比例。通过高脂肪 CR 饮食加强癌细胞 SCD 表达或提高循环脂质水平,可以抵抗 CR 的影响,而改变 KD 脂肪组成以增加肿瘤饱和脂肪酸水平与降低的肿瘤 SCD 活性共同减缓肿瘤生长。
该研究支持一个模型,即CR通过改变肿瘤脂质可用性来抑制肿瘤生长,同时也抑制肿瘤SCD活性,无论是外源性SCD表达还是HFCR-Palm,或通过恢复肿瘤18:1(n-9)/18:0比例,可以减轻饮食的抗肿瘤作用。KD对肿瘤生长的影响可能依赖于膳食脂肪组成,这与KD- palm增加肿瘤SFAs的模型一致,后者与KD介导的肿瘤SCD抑制协同作用,损害肿瘤生长。
综上所述,该研究表明饮食可以改变肿瘤代谢物的利用率,影响癌细胞的代谢,从而影响生长。更好地理解饮食对肿瘤代谢和进展的影响可能导致采用正交策略来模拟特定饮食的影响,并为如何结合饮食干预来改善癌症患者的护理提供指导。

 粤公网安备 44030902002254号
粤公网安备 44030902002254号