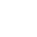前沿技术 |【science】植入式周围神经冷却止痛装置

近日,美国西北大学John Rogers教授、俄勒冈大学Jonathan Reeder助理教授、大连理工大学解兆谦教授等人在国际顶刊Science(IF=63.7)上发表了题为《Soft, bioresorbable coolers for reversible conduction block of peripheral nerves》的研究。
丨研究背景:
阿片类药物是临床上广泛使用的止痛剂,治疗功效很好;但是阿片类药物在镇痛的同时也会产生欣快感,成瘾率较高,因此常发生滥用;另外过量服用阿片类药物可能会导致死亡。阿片类药物滥用造成了极大的社会负担,但也因此推动了局部、非阿片类药物和非成瘾性疼痛管理技术的发展。
已有研究发现,神经组织的代谢、电信号生成和离子活动存在低温依赖,即局部冷却会降低神经活动的传导速度和信号幅度。如在15℃以下,哺乳动物的神经复合动作电位会发生下降、传输阻塞。因此对周围神经进行局部冷却是一种很有发展前途的止痛方式。但当前神经冷却的方法存在材料过硬、系统比较笨重以及冷却靶向不够精确等问题。
丨装置介绍:
冷却镇痛装置基本原理——在适当的时间内提供按需局部镇痛,并随后进行降解或生物吸收。对临床应用场景有如下要求:
1.异常神经信号必须沿明确的神经传导;
2.携带异常神经信号的神经可被单独隔断出来;
3.术后需要使用阿片类药物镇痛(图1A)。
因此,在支配受损组织的神经周围植入一个可生物吸收的冷却装置,可以可逆地快速消除神经疼痛信号(图1B)。可水溶性降解材料在愈合过程完成后会导致冷却装置降解,无需二次手术取出 (图1C)。
该团队研发的装置由混合微流体系统和电子系统组成,具有周围神经冷却和温度传感两个功能,用于冷却并同时测量周围神经的温度。系统具有良好的柔性、可拉伸的力学特性(图1D),弹性模量与周围神经的弹性模量[大鼠坐骨神经弹性模量为0.6MPa]接近。装置的末端是“袖带样”的卷曲结构,其直径与大鼠坐骨神经(1.5mm)接近,以提供紧密的机械和热界面,无需缝合(图1E)。该系统完全由水溶性成分材料构成,可控降解。图1F为加速老化测试,装置包裹在硅胶假体神经周围,并浸没在75℃的PBS溶液(pH7.4)中。结果表明,在这些条件下,材料在20天内大部分降解, 50天后完全降解。

图1.柔性生物可吸收神经阻滞冷却器
丨结构设计:
图2A为混合微流体-电子器件的各层结构图示。微流体系统包括输送液体冷却剂——全氟戊烷(PFP)的通道和输送N2的完全密封的S形蒸发室(图2B)。PFP已在临床上被批准作为加压计量吸入器中的推进剂、静脉内超声造影剂和低温治疗中使用。PFP在28℃至30℃附近沸腾汽化,具有生物惰性并与非氟化弹性体相容的特性。温度传感元件位于装置的末端。
PFP和N2同时流入两个通道,以促使PFP更快的汽化。PFP和N2的流量以及蒸发室的几何形状决定了冷却效果的大小和范围。在低摩尔流量比(XPFP=0.1)下,PFP在通过三个S形管后完全蒸发,在微流体通道的拐角边缘处有液体积聚(图2C);在高摩尔流量比(XPFP=0.5)下(图2D),装置温度在流动后2分钟内可降至-20℃(图2E)。系统的冷却区域主要集中在S形蒸发室中,由通道设计和流体流速控制。
S形镁迹线宽度和长度分别为25mm和72mm,通过Mg的电阻温度系数提供温度反馈(图2F),以防止冷却温度过低损伤神经。
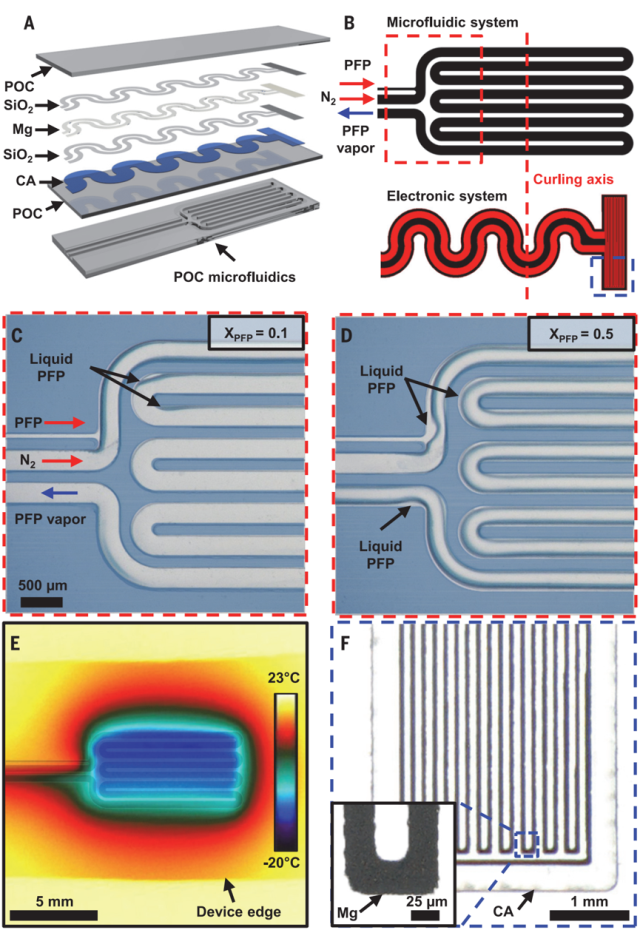
图2.微流控冷却&温度传感系统组成示意图
丨体外测试:
体外测试装置示意图如图3所示,在37℃环境下的,PFP和N2的温度在90mm内与环境温度达到平衡。冷凝器放置在系统的远端,可重新捕获90%蒸发后的PFP。
1.PFP不同流速下的特性测试:将N2压力保持在7-90kPa,并将PFP流速从0到900ml/min缓慢增大,图4A显示了PFP流速与N2流速的相关关系,图4B是同样范围的摩尔流速相关关系结果。在0.13的PFP摩尔分数、90kPa的N2压力下达到最低温度为-1.4℃(图4C)。PFP流速在300μl/min时达到最大神经冷却速率3℃/s(图4D)。
2.复温特性:复温曲线,受PFP流速的控制(图4E)。N2压力保持34kPa,PFP流速为300μl/min时,将神经冷却至3.0℃可保持15分钟。(图4F)。
3.神经周围流体与血流的影响测试:在纯传导环境(水凝胶,37℃)和对流效应(水,37℃)的环境中进行的比较测试 (图4G)。神经血流量从0-50μl/min,对应神经温度升高2.0℃(图4H)。数据显示,在37℃的PBS中进行连续21天每日180秒的冷却,冷却温度的标准偏差为0.6℃(图4I)。
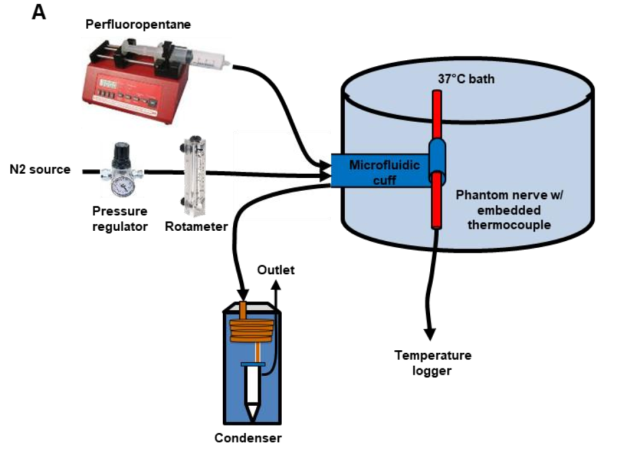
图3.体外测试装置示意图

图4.体外测试研究结果
丨动物实验:
动物试验装置如图5所示。在8min内将大鼠坐骨神经从31℃冷却到5℃,胫骨前肌的肌电图(EMG)表明,幅度降低92%,信号潜伏期增加64%(图6A),复温后在3分钟内分别恢复到初始值的108%和100%;另外,从33℃冷却到4℃时(15min内),复合神经动作电位(CNAP)信号记录表明,幅度降低77%,信号潜伏期增加97%(图6B),复温3分钟,幅度和潜伏期分别恢复到其初始值的101%和97%。
在坐骨神经损伤(SNI)的神经性疼痛大鼠模型中,在坐骨神经上植入的生物可吸收微流体蒸发冷却和温度传感系统(图6C),并沿着皮下脊柱神经到达头帽(图6D)。安装在头帽内的集成连接器与植入装置有微流体与电子系统的连接(图6E)。对两只对照动物(SNI)进行的机械伤害敏感性测试显示,与健侧相比,SNI侧的机械敏感性阈值增加。实验组三只动物接受SNI和冷却装置植入处理。结果表明,在植入3周后将SNI处理的神经从37℃冷却到10℃导致机械敏感性阈值增加七倍(1.6到11.5g),与显著的冷却诱导镇痛作用一致(图6F)。在SNI处理的神经冷却期间,对侧机械敏感性阈值的变化在统计学上不显著。1、2、3和6个月后的组织学分析表明该装置的生物相容性和生物吸收良好,如图7所示。

图5.动物实验装置示意图
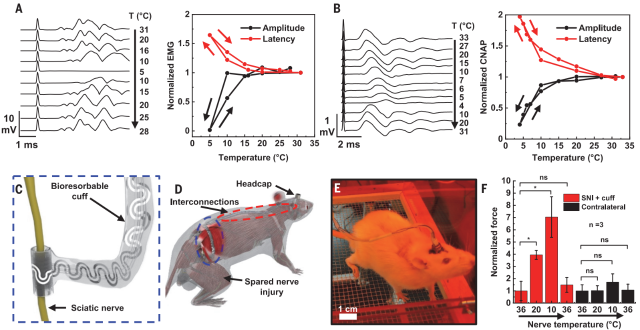
图6.动物实验及结果图
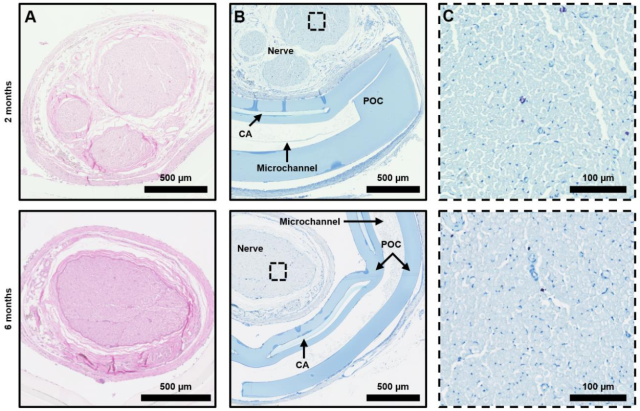
图7.植入后2&6个月的组织学分析结果
丨主要结论:
研究结果表明,可生物吸收的蒸发式微流体实现了精确降温局部周围神经活动的可逆的镇痛。这些材料和装置设计奠定了植入式周围神经冷却镇痛系统的工程基础,能够进行靶向神经阻断,相关临床应用有靶向、按需、非阿片类疼痛管理。
编者按:本篇短文为文献原文的重点摘录。如需了解原文全部内容及其引文,请参考https://www.science.org/doi/10.1126/science.abl8532。(点击 “ 阅读全文 ” 即可跳转至原文链接)
【免责声明】
一、本平台部分文章系编辑转载,转载目的在于传递更多信息,并不代表本公众平台赞同其观点和对其真实性负责。如涉及文章内容、版权和其它问题,请与本平台联系,经核实后,我们将根据著作权人的要求,立即更正或者删除有关内容。
二、本平台原创文章版权归本平台或原作者所有,未经本平台或原作者许可,任何人不得擅作他用。
三、本平台拥有对此声明的最终解释权。
—END—
来源 | 和义广业创新平台
作者 | 易长城
编辑 | 丁小雅

 粤公网安备 44030902002254号
粤公网安备 44030902002254号