前沿技术丨肿瘤的多路复用成像

近日,美国哈佛医学院联合斯隆凯特琳纪念癌症中心,于Nature Biomedical Engineering在线发表了综述文章《肿瘤的多路复用成像》。我们将主要信息摘要如下:
临床分子成像技术用于肿瘤诊断,确定治疗疗效并监测疾病复发。多路复用方法增加了可同时检测到的疾病特异性生物标志物的数量,如致癌蛋白的过表达、代谢产物的异常和异常血液灌注。于该综述中,作者讨论了已建立的和新兴的多路成像技术,这些技术应用于组织的细胞成像,以及无创全身成像。
“多路复用”是指,沿单个通信通道同时传输多个消息。例如,通过循环生物标志物的分子和细胞分析的液体活检,可以增强通过医学成像所获得的诊断信息的准确性和价值。多路复用可以跨越解剖学、生理学和分子水平。
下表中总结了不同的模式,以及有关分辨率、多路复用能力和主要(潜在)临床用途的概要信息:

注:因版面限制,本表为原表的部分摘录。
在体内全身成像技术中,CT、PET、MRI 以及荧光成像被用于为关键临床决策提供信息。来自这些已建立的模式的多路复用信息,将大大提高诊断的准确性。
CT - 依靠内源性造影剂来绘制解剖特征图。外源性造影剂可用于增强脉管系统(使用碘)或消化系统(使用钡)的图像。目前正在开发新的CT技术,以显著提高这种成像方式的能力。其中,phase-contrast CT(PC-CT)的主要优点是,与传统的基于吸收的图像相比,它产生的软组织对比度要好得多。已经证明,PC-CT可以解析导管结构,实现乳腺导管癌和胶原结构的3D可视化,而无需施用外源性造影剂。另一种新兴的CT技术是“photon-counting detector”(PCD)CT。该技术有潜力通过将入射X射线光谱分解为多个能量仓,以增加双能CT的复用能力,并能同时区分多种造影剂(钆、碘和铋)的成像。
PET - 依靠放射性同位素发射的正电子的湮灭产生光子,然后检测和重建以提供3D图像。不同的放射性核素用于患者的诊断成像,包括18F、68Ga、64Cu 和89Zr。这些核素可以共价连接或螯合到小分子化合物或抗体中,以产生示踪剂,例如用于绘制葡萄糖代谢图的18F-氟脱氧葡萄糖,或用于基于抗体的免疫PET成像的89Zr-MAb。通过使用不同同位素的组合和不同PET示踪剂的交错注入,PET成像可用于检测更多目标。
SPECT- 依赖于检测源自核衰变的单光子(γ射线),而非检测正电子湮没。可以区分不同的放射性核素,因为它们发射不同能量的γ射线(125I为 35 keV,99mTc为 140 keV,111In为 200 keV)。额外施用放射性示踪剂可能会引起辐射剂量增加,而具有更高灵敏度探测器的全身PET扫描仪可以将采集时间提高40倍,它们可以捕获更多的湮灭光子对,从而减少辐射剂量,同时提高图像对比度。
MRI - 基于组织中质子(或其他原子核)的核自旋的弛豫性。在某些情况下,通过磁共振波谱(MRS)获得的数据可以提供进一步的化学信息,通常是组织中的代谢物。磁共振指纹(MRF)是一种较新的技术,可以根据“指纹”将扫描中的每个像素匹配到已知参考库中。见下图:
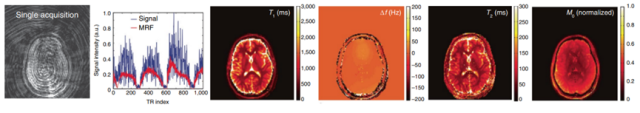
图1 MRF记录组织对施加磁场变化的响应,同时跟踪多个参数
Δf, off-resonance frequency; M0, proton density; TR, time repetition.
使用造影剂的多路MRI可以追溯到30年前,经探索发现,可使用 Mn和Gd的T1和T2弛豫时间的差异来定量解耦并在模型中识别。因此,应可以通过利用MRI的多参数能力来设计其他正交造影剂,一次指向多个目标。然而,与CT一样,MRI灵敏度有限,难以检测体内低丰度的生物标志物。
传统的磁共振波谱成像 (MRSI) 原则上可提供多种不同参数或代谢物的信息。然而,患者运动的情况下获取光谱存在挑战。超极化MRI(HP-MRI)的出现,使基于MRS的多路成像可能成为现实。超极化状态是通过对齐核和电子的自旋而引起,通常是通过动态的核极化,使信噪比增加 10,000-100,000倍,从而允许通过MRSI实时测量代谢物的转运、交换、代谢和灌注。一旦成熟,该技术有望帮助临床决策,例如,在任何疗效的解剖学迹象可识别之前,允许就最佳抗癌药物方案进行患者分层。
术中影像学 - 荧光成像,适用于手术和内窥镜检查期间的原位成像。在使用分子探针来增强荧光、引导手术。基础原理和需求是用分子信息增强对比度(即外科医生所看到的),以更好地定义肿瘤边缘并将难以看到的重要结构(例如神经和输尿管)可视化或探测功能信息(例如泄漏,或吻合术后血管的通畅性)。基于量子点的前哨淋巴结映射方法在临床前研究中显示出希望,它们的荧光发射波长可以通过改变其大小来调谐到不同的颜色。(见下图)已经产生了生物相容性量子点。

图2 硅基量子点(左,彩色图像;右,发射光谱)
对于肿瘤的术中成像,通过使用不同的激发和发射滤光片连续进行荧光成像,可以在术中映射多个荧光团。在临床上已用于在腹腔镜检查期间,用吲哚菁绿(ICG)绘制前哨淋巴结,用荧光素绘制淋巴管,或用于酶促活化染料的比例检测,该染料在肿瘤附近会改变颜色。(见下图)
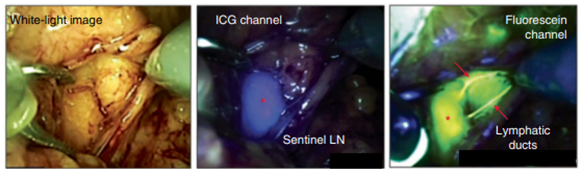
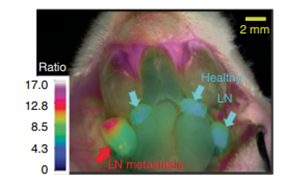
图3(上)腹腔镜下使用两种荧光染料识别前哨淋巴结
(下)酶切后改变其发射的荧光染料可提供癌组织存在的对比信号
基于显微镜的方法可提高术中荧光成像在肿瘤微环境映射中的分辨率。(见下图)其中使用血管探针、抗体偶联荧光团和酶促活荧光团的组合可视化肿瘤微环境的不同组分。类似的方法已被用于研究小鼠自身免疫性疾病。
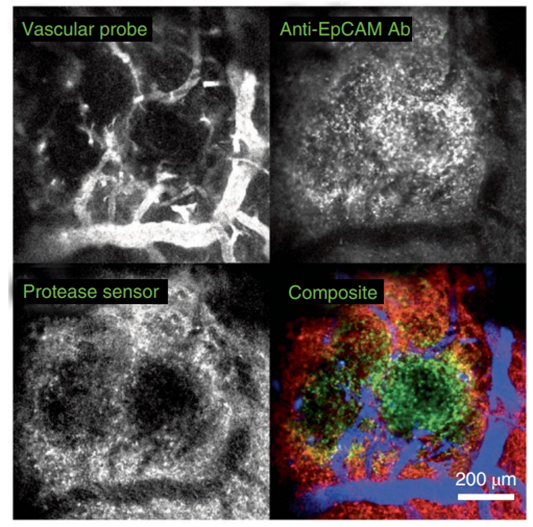
图4 通过活体显微镜(IVM)实现微观尺度的分子检测,以跟踪各种荧光染料信号
丨新兴技术
光声成像 - 光声成像使用超声波和光,组合在体内产生对比度。当分子被光脉冲激发时,吸收的不同能量转化为热量。脉冲激光会产生重复的热弹性膨胀,每次发射的声波都可以通过超声成像可视化。多光谱光声断层扫描(MSOT)利用光声效应提供组织中光分子吸收的3D图像。MSOT比纯光学成像技术(如荧光)实现了显着更大的穿透深度(达5厘米),主要是因产生的超声波不会像光子那样被组织衰减或散射。MSOT非常适合对含色素的组织(如黑色素瘤)进行成像。
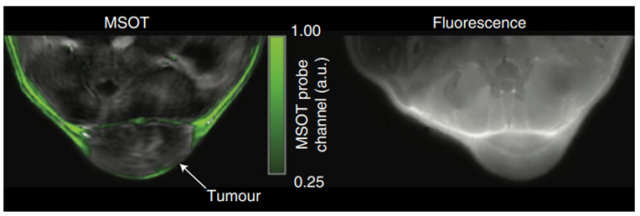
图5 用于MSOT的外源性靶向造影剂可以与来自内源性分子的信号分离

图6 内源性造影剂,如氧血红蛋白和脱氧血红蛋白,可用于组织氧合成像
拉曼成像 - 拉曼散射依赖于入射光子与样本之间的能量交换,对样本的分子结构很敏感,因此不同的散射光谱可以用来检测特定的化学物质。它的一个限制是,很少有光子经历拉曼散射(大多数光子经历弹性瑞利散射),因此,固有的拉曼信号比荧光信号要弱得多,该技术对于大多数体内应用需要非常长的采集时间。相关方法,例如受激拉曼散射(SRS)和相干反斯托克斯拉曼散射(CARS),可用于增加信号强度,但它们一次只能成像一个能带,不能提供整个光谱。传统的拉曼成像、SRS和CARS也可用于显微镜检查,根据固有对比度对组织切片和其他生物样品进行无标记高分辨率分析。
对比度增强拉曼成像 - 表面增强拉曼光谱(SERS)需要纳米级造影剂。在SERS中,贵金属表面激发的表面等离子激元,可在不影响信号特异性的情况下大规模放大附近分子的拉曼效应。已经出现了具有临床转化潜力的SERS纳米粒子多重成像。一种是探针靶向在某些卵巢癌中过度表达的叶酸受体;另一种是非靶向探针,用于解释非特异性背景的纳米颗粒的摄取。解耦两个纳米探针的光谱信号,两个探针的比值可用来识别微观新陈代谢。类似的比率策略,采用多达四种不同的靶向纳米颗粒和一种非靶向对照,来识别患者离体样本中的乳腺癌。(见下图)
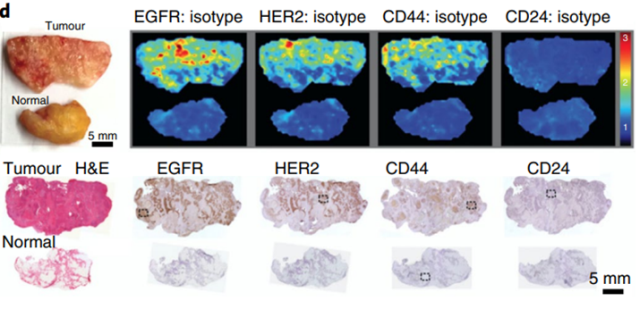
图7 用五种不同的纳米颗粒局部染色,人类乳房肿瘤切除术标本的多路成像
丨展望
对于一次扫描中同时成像多个分子靶点将提供有价值的临床信息,还可减少与单独测量相关的时间和成本。可进一步开发多路复用成像,以检测整个信号通路或多组学应用。临床前模型的工作表明,原则上,信号通路的多路成像是可行的。然而,获得监管批准用于人类的过程存在重大门槛。首先,多重成像技术可能需要使用多种造影剂,每种造影剂都需要自身的试验和批准。此外,串行成像方法可能会增加扫描时间,超出患者预期能够承受的时间。此外,对多个数据通道的解释将需要复杂的数据处理。因此,为了实现多路临床成像,患者的受益需求很大,不仅限于减少测试次数。测试多路成像诊断技术的有效性,受控性、前瞻性和观察性临床试验的设计是最重要的,且应使用多重成像来指导治疗或外科手术。开发和实施多路成像的路线图,遵循组合疗法的成功路线图,并将推动放射学的创新。
编者按:本篇短文为文献原文的重点摘录。如需了解原文全部内容及其引文,请参考https://doi.org/10.1038/s41551-022-00891-5。(或点击 “ 阅读全文 ” 即可跳转至原文链接)
【免责声明】
一、本平台部分文章系编辑转载,转载目的在于传递更多信息,并不代表本公众平台赞同其观点和对其真实性负责。如涉及文章内容、版权和其它问题,请与本平台联系,经核实后,我们将根据著作权人的要求,立即更正或者删除有关内容。
二、本平台原创文章版权归本平台或原作者所有,未经本平台或原作者许可,任何人不得擅作他用。
三、本平台拥有对此声明的最终解释权。
—END—
来源 | 和义广业 周琦芸
编辑 | 丁小雅

 粤公网安备 44030902002254号
粤公网安备 44030902002254号